Virol J:HPV致癌机制大揭秘!科学家用AI“拆解”病毒蛋白,找到抗癌新靶点
来源:生物谷原创 2025-11-07 11:04
研究借助人工智能和结构生物学技术,成功 “拆解” 了 HPV 关键蛋白 E2 的结构,锁定了导致癌症风险升高的核心突变(如 HPV52 的 T309P),为抗癌药物研发提供了精准靶点。
你有没有想过,一种感染了全球近 80% 性活跃人群的病毒,竟能在人体内 “潜伏” 几十年后突然引爆癌症?这就是人乳头瘤病毒(HPV),它不仅是宫颈癌的首要元凶,还是肛门癌、阴茎癌以及部分头颈癌的主要致病因素。尽管 HPV 疫苗已广泛普及,但为何部分亚型的致癌能力远超其他?科学家们一直在寻找答案。
近日,美国特拉华大学的研究团队在《Virology Journal》发表重磅研究,借助人工智能和结构生物学技术,成功 “拆解” 了 HPV 关键蛋白 E2 的结构,锁定了导致癌症风险升高的核心突变(如 HPV52 的 T309P),为抗癌药物研发提供了精准靶点。

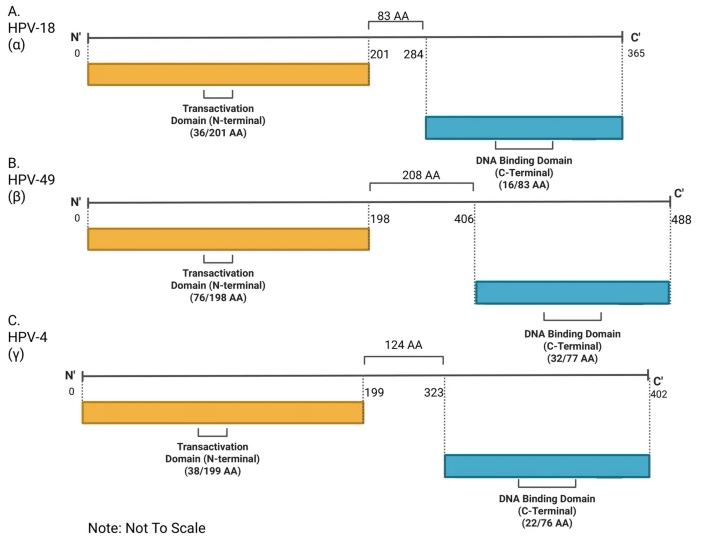
典型HPV属E2蛋白结构域示意图
尤其值得注意的是 HPV52 亚型 B2 中的 T309P 突变。HPV52 在东亚人群中感染率较高,而 T309P 突变被证实与癌症风险升高密切相关。结构建模显示,这个单氨基酸替换会导致 E2 蛋白的多肽链发生明显弯折,局部二级结构从 “延伸链” 转变为 “β- 桥”,相邻的组氨酸残基也从延伸链变为无规则卷曲,直接影响 E2 与 DNA 的结合能力和调控功能。更关键的是,研究团队通过多序列比对发现,苏氨酸(T)在 309 位同源位点仅存在于 2.3% 的 HPV 亚型中,而脯氨酸(P)也仅占 1.9%,但在高危亚型 HPV33、HPV58 中,该位点天然就是脯氨酸,这暗示该残基的类型可能是 HPV 致癌能力的 “开关”。
“我们现在所做的研究,五年前根本不可能实现。”Fletcher 表示,借助机器学习,研究团队能快速识别蛋白质中隐藏的结构规律,精准定位致癌突变并设计阻断方案。Esther Biswas-Fiss 教授强调,过去很多研究侧重于 HPV 的流行病学与临床分析,但要真正预防和治疗 HPV 相关癌症,必须从分子层面理解其作用机制。“我们必须在计算与实验两条路上并进,这篇论文为我们打开了新的探索通道。” 目前,Fletcher 已获得 “特拉华 INBRE 学年研究员奖”,后续他将继续用这套 “计算显微镜” 深入分析 HPV 每一个蛋白的原子结构,寻找更多抗癌靶点。
这项研究的意义远超单一蛋白解析。E2 蛋白的核心功能是抑制致癌基因表达,而当它因突变失去功能时,HPV 基因组整合到宿主 DNA 中,就会引发癌症。研究锁定的保守残基和突变位点,为药物设计提供了精准方向。未来或许可以开发小分子药物,稳定 E2 蛋白的正常结构,或恢复突变体的抑癌功能。尽管 HPV 古老而复杂,但随着 AI 与结构生物学的深度融合,科学家们正一步步揭开其致癌的 “分子底牌”,未来有望实现对 HPV 相关癌症的精准防控和治疗。(生物谷Bioon.com)
参考文献:
Fletcher, S., Biswas-Fiss, E.E. & Biswas, S.B. Structural and functional roles of conserved residues of human papillomavirus (HPV) E2 protein and biological consequences. Virol J 22, 278 (2025). doi:10.1186/s12985-025-02903-7
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


